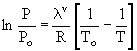Guía de
Trabajos Prácticos
Cátedra: Termodinámica
Trabajo Práctico: Equilibrio Físico de Sustancias Puras -
Medición de Presión de Vapor
Carrera: Ingeniería Química
Objetivos
Analizar
el equilibrio entre fases para una sustancia pura.
Introducción
Cuando un líquido está en equilibrio con su
vapor a una temperatura dada, el vapor ejerce una presión que sólo depende de
la temperatura, y que se denomina “presión de vapor”.
El
valor de la presión de vapor es independiente de las cantidades de líquido y
vapor presentes, por lo cual, a distintas temperaturas se obtendrán distintos
valores de presión de vapor, los cuales constituirán puntos de la “curva de
saturación” para la sustancia en estudio.
Fundamentos
El efecto de la temperatura sobre la presión
de vapor puede analizarse termodinámicamente a partir de la expresión de la
condición general de equilibrio:
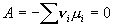
Para un
compuesto puro: 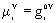 ;
; 
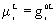
Luego: 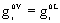 . Diferenciando:
. Diferenciando: 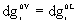
g es una
función de estado de T y P \ 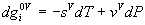
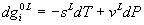
de donde
se puede concluir que:
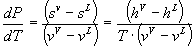 (I)
(I)
Esta es la
ecuación de Clapeyron, que es rigurosa y también aplicable a los
equilibrios S-L y S-V.
Al ser una expresión rigurosa, puede
ser utilizada como test de consistencia termodinámica.
A partir de (I) y considerando como
hipótesis válidas que:
.
vL << vV (esto ocurre lejos del punto crítico)
.
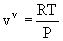 (ecuación de estado
de los gases ideales)
(ecuación de estado
de los gases ideales)
se arriba
a: 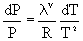 (II)
(II)
Esta
es la ecuación de Clausius-Clapeyron, la que brinda una relación funcional
fácilmente integrable entre la temperatura y la presión de saturación para el
equilibrio Líquido-Vapor (con similares consideraciones es aplicable al equilibrio
Sólido-Vapor).
Las
ecuaciones de Clapeyron y de Clausius-Clapeyron son herramientas que permiten
evaluar en forma crítica los resultados de las mediciones de temperaturas y
presiones de saturación, efectuar correlaciones semiempíricas, estimar propiedades,
etc.
Técnica experimental para la construcción de una
curva de saturación
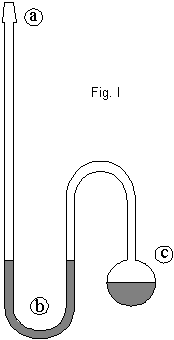
En el
dispositivo de la Fig. I, llamado ISOTENISCOPIO, se coloca en (c) la sustancia
cuya presión de vapor se desea medir. Para eliminar el aire del sistema, que
introduciría errores, se hace vacío en el isoteniscopio y en las otras ramas,
incluido el manómetro (8), Fig. II.
Luego se
inclina el equipo y se hace pasar líquido desde (c) hasta (b), de modo de
formar un sello de líquido en (b) de aproximadamente 3 cm.; posteriormente se
sumerge el isoteniscopio en el baño termostatizado (12), con lo que ambas ramas
en el tubo (b) se desequilibran. Para equilibrar ambos niveles se puede hacer
ingresar aire seco por (10) o bien hacer vacío nuevamente.
Una vez logrado esto, se realizan
las mediciones de presión de vapor ya que, equilibrando ambas ramas del tubo (b) se asegura que la presión
dentro de (c) sea la misma que se mide en el manómetro de Hg (8).
Aunque se haya hecho entrar aire a
la izquierda del sello (b), debe cuidarse muy especialmente que el aire no
ingrese en (c); esto es lo que asegura que el manómetro mida la presión de
vapor de la sustancia pura.
La temperatura se mide con un
termómetro (7), y puede variarse mediante el uso de un baño termostatizado.
Esquema del dispositivo utilizado
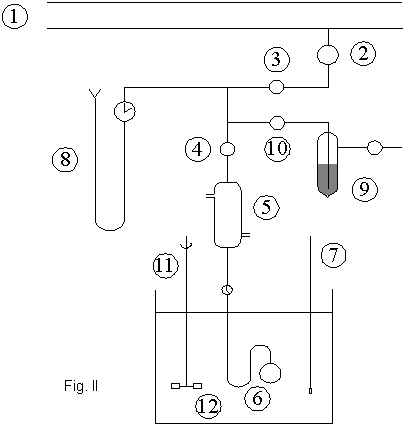
(1) Distribuidor
de vacío central (5) Condensador (9) Desecador de aire
(2) Válvula,
conecta a vacío central (6) Isoteniscopio (10) Válvula ingreso de aire
(3) Válvula (7)
Termómetro (11) Agitador
(4) Válvula (8)
Manómetro de Hg (12) Baño termostatizado
Tratamiento de datos
Se
construye la curva de saturación para el equilibrio L-V (P vs Tsat),
sobre la que pueden descartarse los puntos erráticos o dudosos.
Luego
se utilizará la ecuación (II), que ofrece distintas alternativas de
integración, de acuerdo a la variación de lv
con la temperatura, según:
1)
lv = cte ¹ f (T)
Recordando la expresión (II):
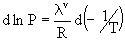
e
integrando esta expresión entre To y T (cuyas presiones de vapor
son, respectivamente, Po y P), se tiene que:
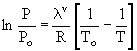 (III)
(III)
La
ecuación (III) tiene la forma
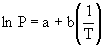 (IV)
(IV)
1.a) Con
los datos experimentales P vs. Tsat puede construirse la curva ln P
vs. 1/T.
1.b)
Mediante el método de los cuadrados mínimos puede obtenerse los coeficientes a
y b de la expresión (IV) y verificar la utilidad de la misma para interpolar
valores de P y T de saturación.
1.c)
Estimar valores de lv
entre un par de valores de P y T de saturación
2)
lv = f (T)
Para gases
perfectos y líquidos incompresibles puede demostrarse que
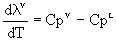 ; luego
; luego
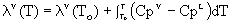 (V)
(V)
De aquí pueden presentarse distintas
alternativas de integración:
2.a) Cpv – CpL
= cte Þ lv(T) = lv(To)
+ (Cpv – CpL)(T-To) ;
que es de
la forma lv(T)
= a’ + b’T
Reemplazando
en (II) se tendrá una función del tipo:
ln P = A + B (1/T) + C ln T (VI)
A
partir de los datos experimentales pueden obtenerse los coeficientes A, B y C
de la expresión (VI) y verificar la utilidad de dicha expresión para interpolar
valores de P y T de saturación.
2.b) (Cpv – CpL) = a” +b”T
Reemplazando
en (V), integrando y luego reemplazando lv
= f (T) en (II), se arriba a una expresión del tipo:
ln P = A’ + B’ (1/T) + C’ ln
T + D’T (VII)
Se
deja para demostrar a qué son iguales los coeficientes a, b, A, B, C, A’, B’,
C’ y D’ en los distintos casos.
Para completar el análisis de los datos
experimentales se pueden comparar éstos, así como los valores que proveen las
ecuaciones (IV), (VI) y (VII), con los datos que provee la bibliografía para la
sustancia utilizada.
Cuestionario
a)
De la expresión de equilibrio entre fases para una
sustancia pura, desarrollar la ecuación de Clausius-Clapeyron.
b)
Suponiendo que lv
es función de la temperatura, obtener las expresiones de las constantes de las
ecuaciones (VI) y (VII).
c)
Enumerar las posibles causas de error.
![]()
![]() ;
; ![]()
![]()
![]() . Diferenciando:
. Diferenciando: ![]()
![]()
![]()
![]() (I)
(I)![]() (ecuación de estado
de los gases ideales)
(ecuación de estado
de los gases ideales)![]() (II)
(II)