Guía de Trabajos Prácticos
Cátedra: Termodinámica
Trabajo
Práctico: Termómetro de Gas
Carrera: Ingeniería
Química
Objetivo
Determinar
la temperatura de una mezcla frigorífica con un termómetro de gas a volumen
constante.
Fundamentos
Teóricos
Si dos sistemas A y B se ponen en contacto mediante
una pared diatérmica común y no experimentan cambio en sus propiedades, se dice
que los mismos están en equilibrio
térmico.
La propiedad que permite determinar si los sistemas
están en equilibrio térmico es la temperatura.
La determinación del valor de la temperatura involucra mediciones indirectas
con instrumentos calibrados llamados termómetros
que se basan en la variación de una propiedad termométrica. Las propiedades termométricas más comunes son:
volumen, presión, resistencia eléctrica y fuerza electromotriz.
Observaciones experimentales permitieron deducir que todos los gases,
independientemente de su naturaleza, presentan el mismo valor de Pv cuando P® 0 a una temperatura dada.
Es decir que: lím Pv =
CTE
P®0
donde la constante es función solamente de la temperatura.
Además, un gas real cumple con la ecuación de los
gases ideales cuando su presión P® 0, es decir:
Pv = RT
(I)
En la termometría se emplean los valores límites de Pv para
establecer una escala de temperatura independiente de la naturaleza del gas.
Así entonces, un termómetro de gas que opera a
volumen constante y cuya propiedad
termométrica es la presión, nos permitirá determinar la temperatura de
cualquier sistema.
Al poner en contacto el termómetro con un sistema A y luego con otro B
con temperaturas diferentes, aplicando (I) se tendrá:
![]() (Pv)A = R
TA
(Pv)A = R
TA
(Pv)B = R
TB
Si el volumen extensivo y el número de moles permanecen constantes, el
volumen intensivo no varía y puede escribirse:
PA
/ PB = TA / TB (III)
Si se toma como temperatura de referencia (conocida) la del sistema A,
podrá calcularse la temperatura del sistema incógnita (B) midiendo las
presiones correspondientes.
Variando la presión del gas
es posible construir una gráfica con un conjunto de pares de valores (TB,
PB). Extrapolando para P® 0 se determina la temperatura real del sistema
incógnita.
Descripción
del dispositivo
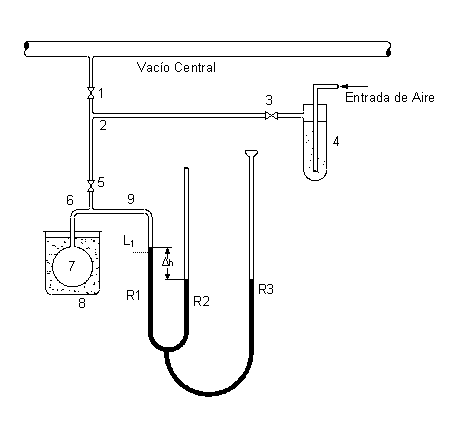
1)
Llave de conexión vacío central – equipo.
2)
“T” de comunicación vacío central – equipo – entrada
de aire seco
3)
Llave de conexión
4)
Secador de aire
5)
Llave de conexión
6)
“T” de conexión exteriores – depósito de gas –
manómetro
7)
Deposito de gas
8)
Baño. Sistema de temperatura conocida / incógnita.
9)
Manómetro de tres ramas: R1 y R2 de medición, R3 de
nivelación
Técnica
Operatoria
Se usará aire
seco como gas del termómetro. Para ello se hace vacío abriendo las llaves 1 y
5, permaneciendo la llave 3 cerrada, de tal forma que se evacue todo el aire
húmedo del sistema; luego se cierra la llave 1 y se abre la 3 para permitir el
ingreso del gas, esta operación se repite varias veces, para asegurar que el
aire dentro del sistema sea lo más seco posible. Esta operación de llenado se
realiza previamente al trabajo práctico. Este consiste en realizar las
mediciones de la presión del gas cuando el bulbo se sumerge en un baño de
temperatura conocida, en este caso hielo-agua, y luego en un baño de
temperatura incógnita (mezcla frigorífica). Con la llave 5 cerrada, se
introduce el depósito de gas en el baño hielo-agua y se deberá manipular R3 de
forma tal que en R1 el mercurio permanezca siempre al mismo nivel L1,
lo que asegura la constancia del volumen. Cuando el sistema esté estable se
mide la diferencia de altura entre R1 y R2 y se calcula la presión según:
![]() (IV)
(IV)
Posteriormente
se cambia el baño, se lee DhB
y se calcula PB con IV y TB con III, obteniéndose el
primer punto de la gráfica TB vs. PB.
Luego se
aumenta la presión por ingreso de más aire seco para obtener los siguientes
pares de valores. Para ello, sin cambiar el baño frigorífico del punto anterior
(para disminuir el tiempo de
estabilización), se abre la llave 3 para que ingrese aire seco, se cierra la
misma para limitar la cantidad y evitar posteriores inconvenientes;
cuidadosamente se abre la llave 5 hasta que la presión aumente menos de 100
mmHg aproximadamente y se repite el procedimiento.
La llave 1
solo se utiliza para evacuar el equipo en el inicio del TP, o cuando surge
algún inconveniente durante el mismo, de lo contrario permanecerá siempre
cerrada, ya que el cambio de presiones se obtiene por ingreso de aire y no por
evacuación.
El baño de
temperatura fija y conocida debería estar dado por el punto triple del agua y
no por el equilibrio sólido-líquido a presión atmosférica, pero debido a las
dificultades para obtener en el laboratorio el equilibrio de las tres fases se
recurre a la simplificación mencionada.
Valores
a observar
Presión
Atmosférica del día: ...........................
|
Experiencia |
|
|
PA |
PB |
TB |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
6 |
|
|
|
|
|
Cuestionario
1)
Concepto de equilibrio térmico
2)
Concepto de isotermas y de temperatura.
3)
¿Qué termómetros conoce?. Variables termométricas.
4)
Uno de los inconvenientes que se trata de evitar es
el ingreso de aire en el termómetro durante una medición. ¿Cómo influiría este
inconveniente?.